近日, ONCOGENE杂志发表了来自西南大学家蚕基因组国家重点实验室崔红娟教授团队题为“CBX3 accelerates the malignant progression of glioblastoma multiforme by stabilizing EGFR expression”的最新成果。

胶质母细胞瘤(Glioblastoma , GBM)是中枢神经系统中比较常见的神经上皮肿瘤,是恶性程度最高的原发性脑肿瘤也是最致命的实体瘤,被世界卫生组织归类为Ⅳ级胶质瘤。GBM 预后差,被诊断后的平均中位生存期为 14个月,其5年生存率为 5%。尽管目前在外科手术,放化疗等医学治疗手段取得了不错的进展,但在延长患者的生存期上仍未取得突破。因此,目前迫切需要筛选鉴定出有效的GBM生物标记物,探索GBM的治疗靶标并解析GBM的发病机理,为GBM的早期诊断及预后评估提供新策略以延缓患者的生存期。
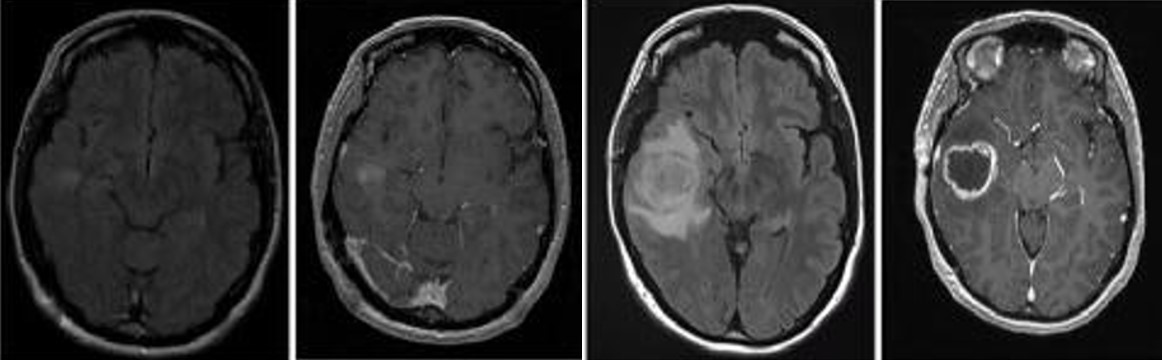
研究表明表皮生长因子受体(EGFR)GBM最常见的基因改变,EGFR的激活与GBM细胞的生长和侵袭密切相关。根据现有统计数据,57% 的原发性 GBM 患者存在 EGFR 突变或异常扩增。作为驱动 GBM病理生理学的信号级联失调的初始上游触发因素,因此EGFR是治疗GBM患者最热门的治疗靶点。
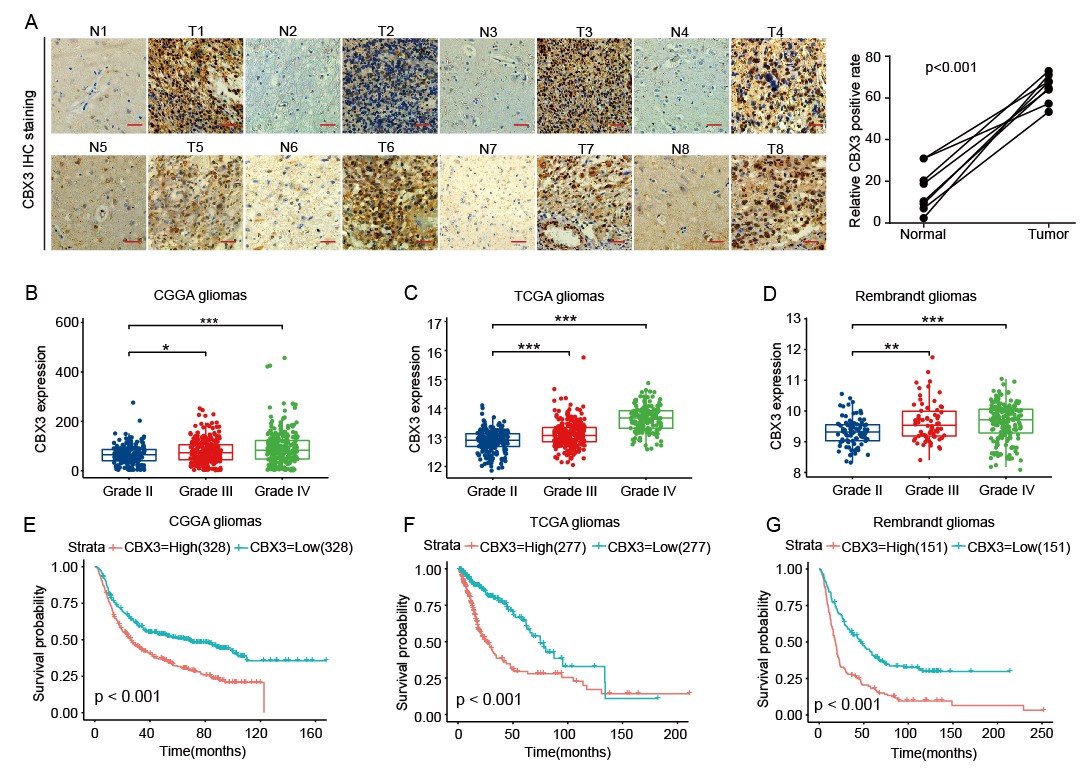
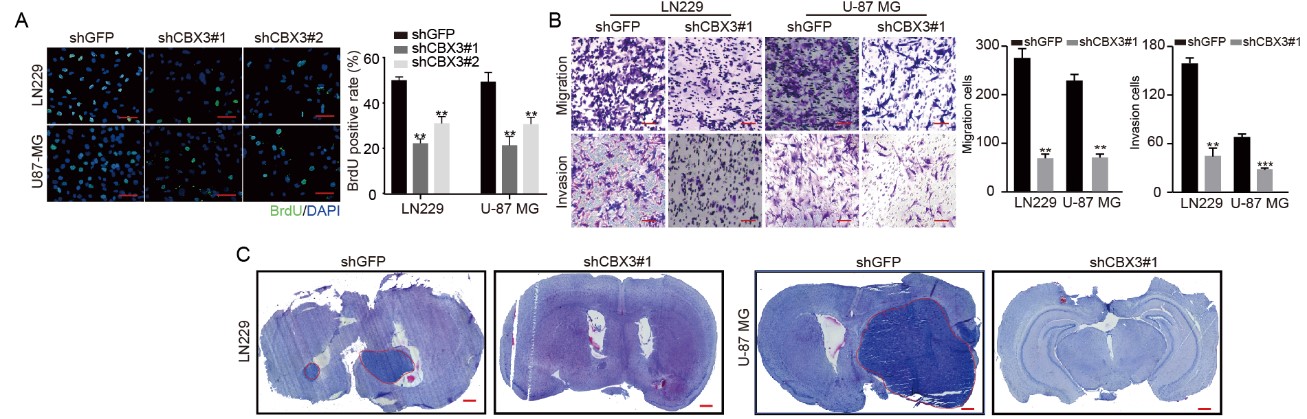
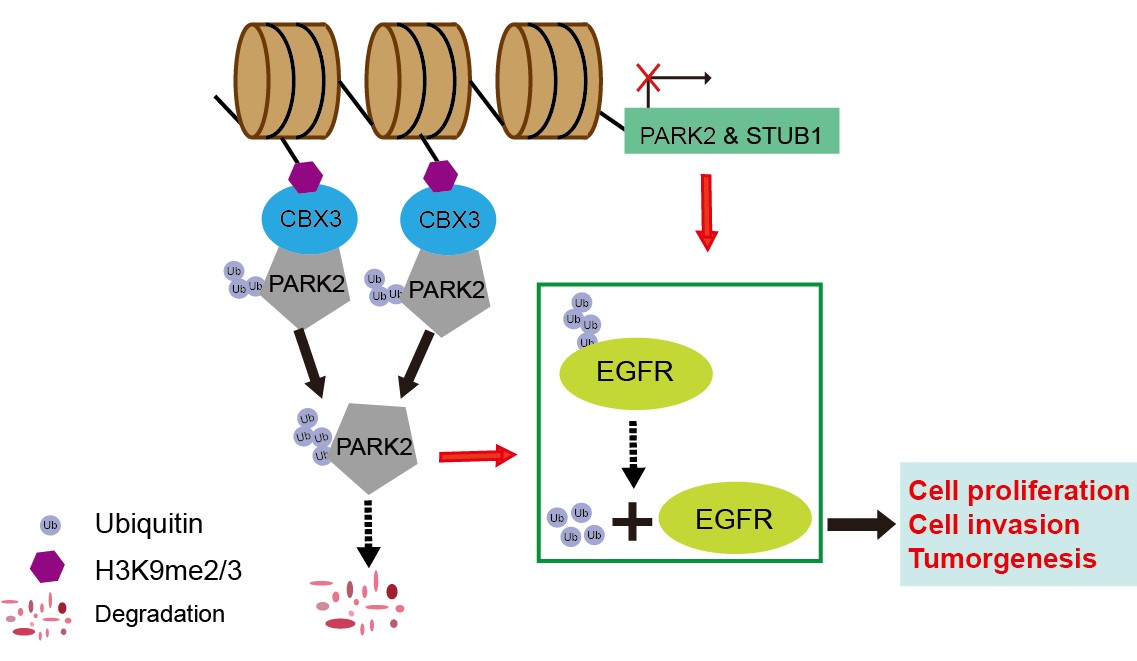
崔红娟教授团队就GBM标志物的筛查、鉴定以及如何管控EGFR在GBM的表达开展了深入研究。首先, GBM患者组织的免疫组化病理检测以及生物信息学分析发现一种能够参与异染色质形成的H3组蛋白甲基化阅读器CBX3(Chromobox 3)在GBM患者中异常高表达,并且与GBM的预后和恶性分级密切相关。功能检测表明了CBX3 在体外和体内显著促进 GBM 细胞的增殖、侵袭和肿瘤发生。从机制上来说,我们通过Ch-IP和Co-IP等一系列生物技术实验证明了CBX3促进GBM 的恶性进展是EGFR 依赖性的,并且进一步揭示了GBM患者发病机理的一条全新的信号通路CBX3-PARK2/STUB1-EGFR。该研究不仅丰富了GBM表观遗传学的研究,也为该信号通路作为GBM潜在治疗靶点的可行性提供了坚实的依据。西南大学2020级博士研究生彭文为第一作者,崔红娟教授为该论文的通讯作者。该研究得到了重庆市自然科学基金和重庆市博士生科研创新项目的支持。
《ONCOGENE》杂志作为国际TOP期刊,是经典的肿瘤权威杂志,由Springer Nature出版商发布,于1997年创刊。影响因子为9.867,中科院分区为医学类一区。
供稿:彭文
审稿:崔红娟