西南大学资源昆虫高效养殖与利用全国重点实验室代方银教授团队发现了调控寿命的新基因OSER1,并在家蚕、线虫、果蝇等多物种中研究揭示了其通过提升机体对氧化应激的防御力而延缓衰老和延长寿命的保守性机制,且该基因对寿命的影响得到人类受试者研究结果支持,展示了OSER1作为实现健康衰老和延长寿命的关键调控靶标的重要前景。研究论文“FOXO-regulated OSER1 reduces oxidative stress and extends lifespan in multiple species”已于8月21日在国际知名期刊《自然通讯》(Nature Communications)在线发表。

FOXO转录因子调节与衰老相关的途径并影响寿命,但介导这些影响的靶点在很大程度上仍然未知。本研究首先查明,寿命调节因子FOXO(s)在不同模式动物间的二级结构具有较高保守性,这为利用家蚕筛选FoxO靶基因提供了依据(图1a)。通过在家蚕BmN-SWU1细胞中上调或下调FoxO的表达水平,结合转录组测序和差异表达分析,筛选到FoxO的候选靶基因180个,其中上游调控区域含有FoxO结合基序的基因有42个(图1b-d)。比较基因组学分析发现,人类基因组中家蚕、线虫、果蝇的直系同源基因占比分别约为30.94%、26.94%和32.20%,即家蚕处于中位(图1e)。分析四个物种中已报道的所有FoxO直接靶基因,显示其中为四个物种共有的靶基因仅1个(图1f),相关保守性因子的鉴定还很匮乏。
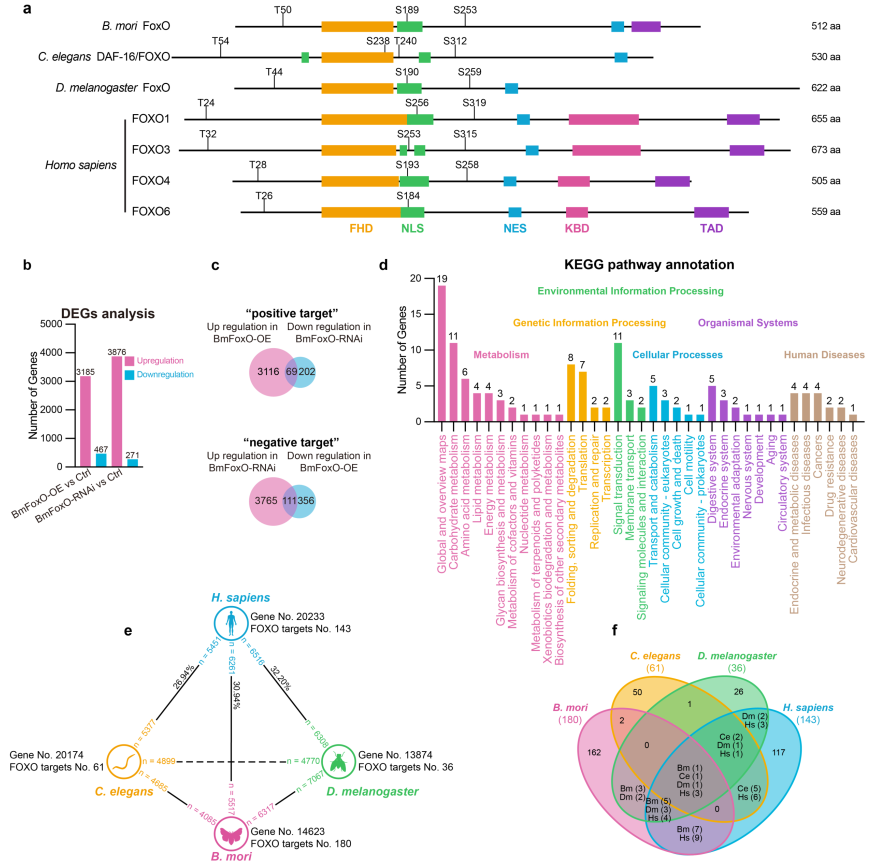
图1. 长寿调节因子FoxO转录结合靶点的鉴定
利用线虫高效干涉平台,对家蚕中FoxO的42个潜在直接靶基因在线虫中的直系同源基因进行干涉实验,发现其中7个基因被敲低后线虫寿命显著缩短,3个基因被敲低后线虫寿命显著延长。其中,家蚕BmOSER1在线虫中的直系同源基因Ceoser1敲低后,线虫寿命缩短17%,缩短幅度最大(图2)。
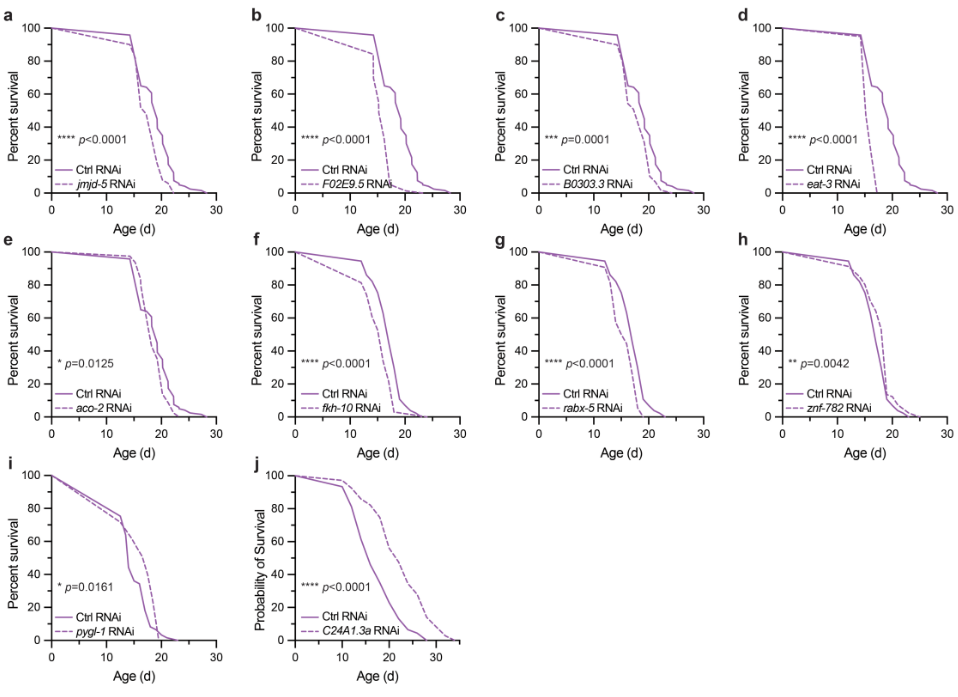
图2. FoxO转录结合靶标影响寿命的效应调查
对线虫、家蚕、果蝇、斑马鱼、非洲爪蟾、小鼠、恒河猴与人类进行比较分析,发现其基因组中均存在OSER1的直系同源基因(图3a)。进一步研究显示,在家蚕、线虫和果蝇中,过表达OSER1后3个物种的寿命均显著延长;而OSER1被敲除、干涉或其突变体中,3个物种的寿命均显著缩短(图3b-h)。
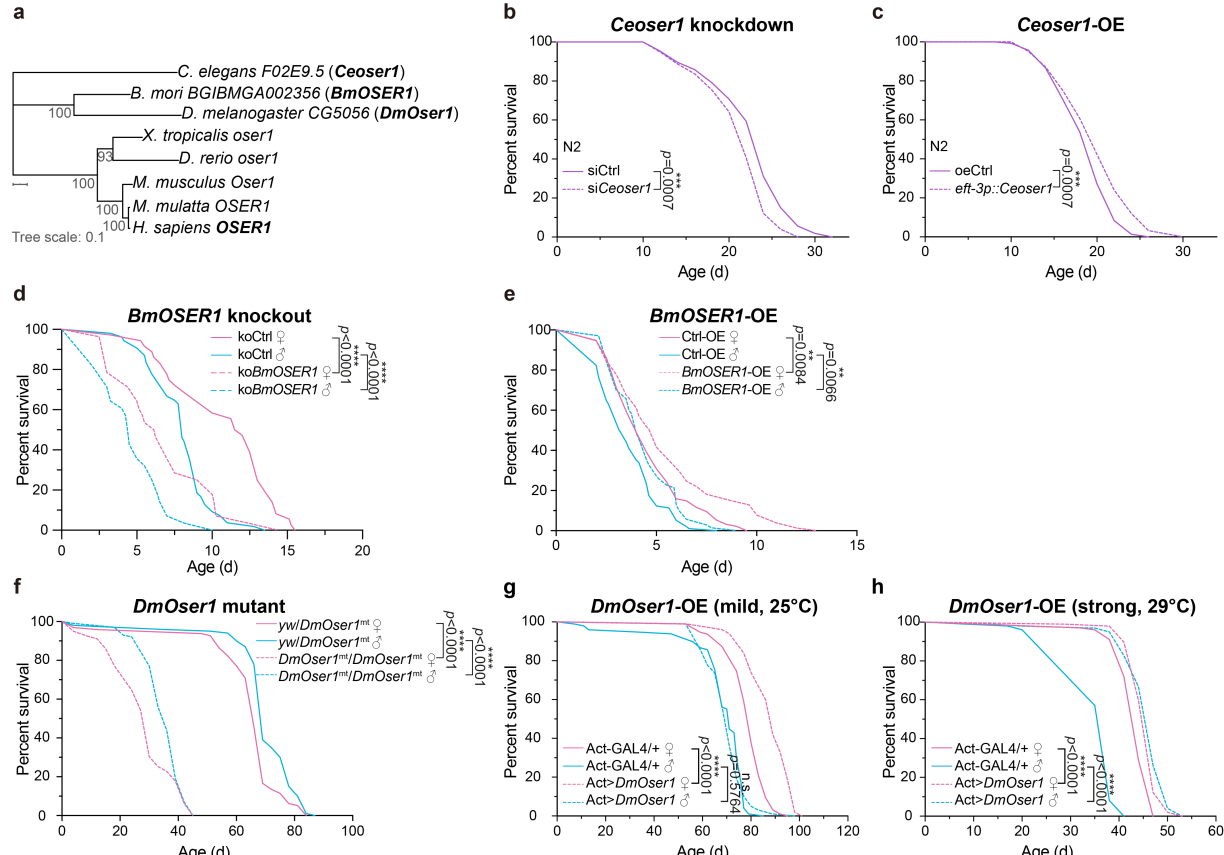
图3. OSER1过表达或敲低对线虫、家蚕和果蝇寿命的影响
为了探明OSER1受FoxO调控的方式,在家蚕中进行ESMA、双荧光素酶及亚细胞定位实验,在人类细胞中进行亚细胞定位及表达调查,研究结果共同表明OSER1是FoxO的直接靶基因,且其蛋白主要位于细胞质中;OSER1能够响应H2O2诱导的氧化应激,其表达趋势与氧化应激典型响应子SOD2表达趋势一致(图4)。
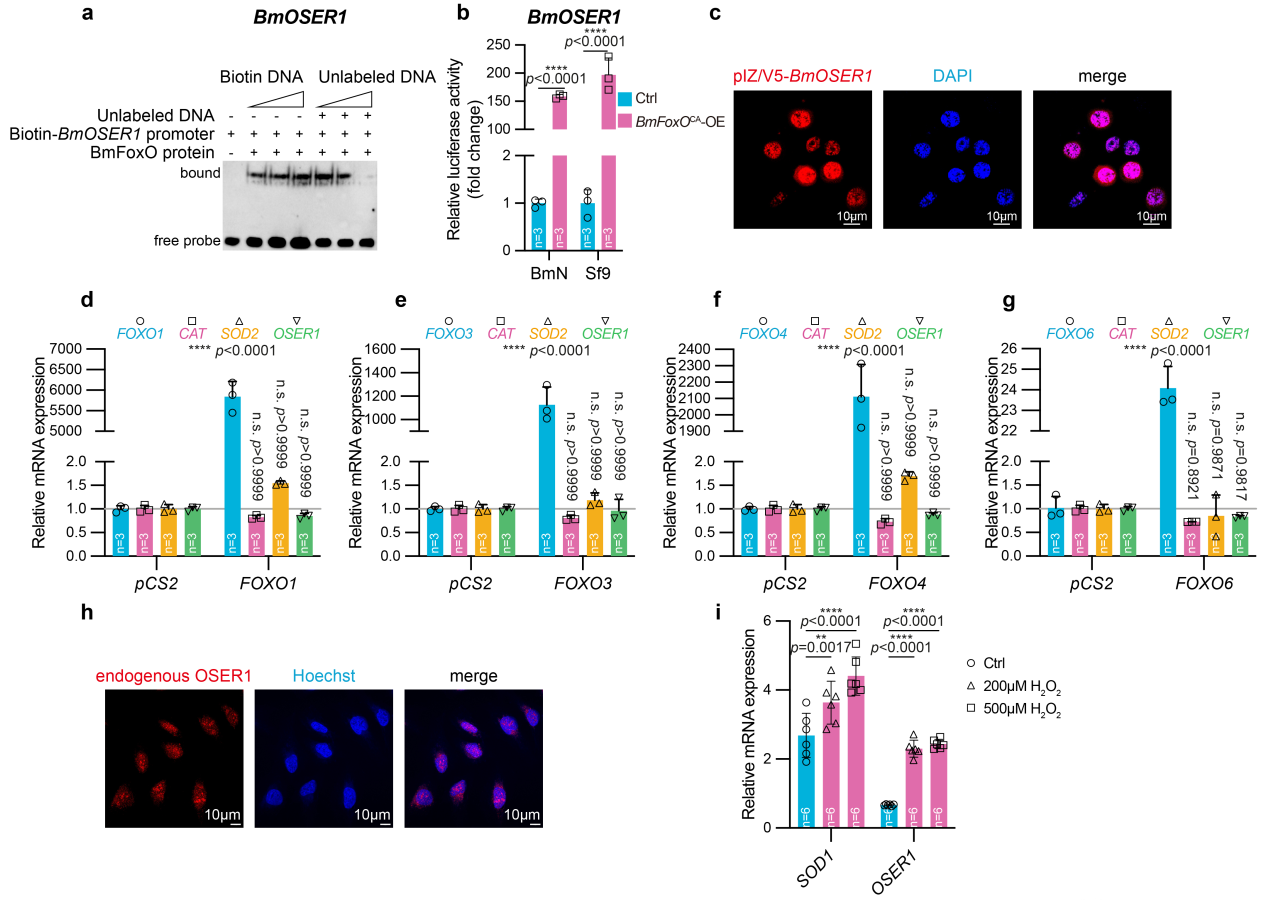
图4. 家蚕和人体内FOXO对OSER1的正向、直接调控作用
在果蝇中的研究表明,DmOser1功能缺失显著降低果蝇对于氧化应激的抵御能力,果蝇的寿命缩短,而DmOser1表达增强则能显著提升果蝇对于氧化应激的抵御能力(图5a-b);果蝇翅原基氧化模型中的研究也表明DmOser1能够显著降低氧化损伤的程度,通过饥饿和热激2种方式诱导的氧化应激研究也获得了类似结果(图5c-h)。家蚕个体和细胞中的研究结果表明OSER1能够响应氧化应激的刺激(图5i-j),过表达BmOSER1后,氧化应激水平被显著抑制,并能够回复被氧化应激提升的BmSOD1和BmCAT的表达水平(图5k-l)。
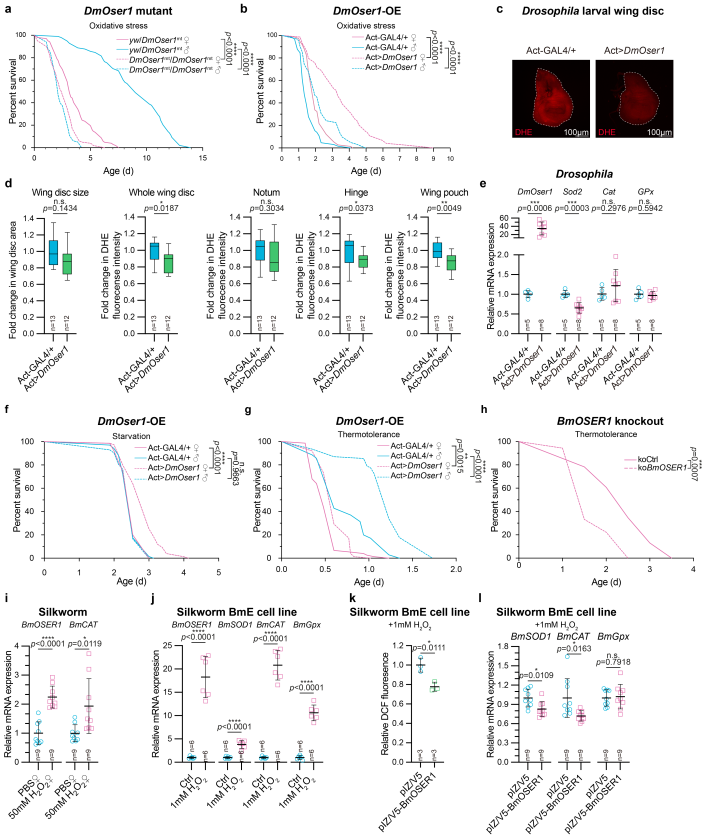
图5. 果蝇和家蚕中OSER1对氧化应激的影响
在线虫中,对干涉Ceoser1的实验组同时添加抗氧化剂N-乙酰半胱氨酸(N-Acetyl Cysteine, NAC),则线虫寿命缩短程度显著变小(图6a);过表达Ceoser1能够显著提升线虫抵御叔丁基过氧化氢(Tert-butyl hydroperoxide, TBHP)诱导的氧化应激的能力(图6b),而线虫oser1干涉组中氧化损伤程度被显著加重(图6c-f)。为了探索OSER1调控氧化应激的潜在机理,对产生活性氧的主要细胞器线粒体的形态和功能进行了调查,结果表明Ceoser1干涉后,线粒体形态异常,发生了明显断裂(图6g-h),其产生ATP的核心功能也受到了显著抑制(图6i)。利用不同信号路径核心元件(daf-2、eat-2、skn-1、pmk1)的突变体进行调查,结果显示OSER1处于daf-2、eat2、skn-1信号路径的下游;干涉OSER1能够显著缩短daf-2突变体的长寿表型(图6j-l)。
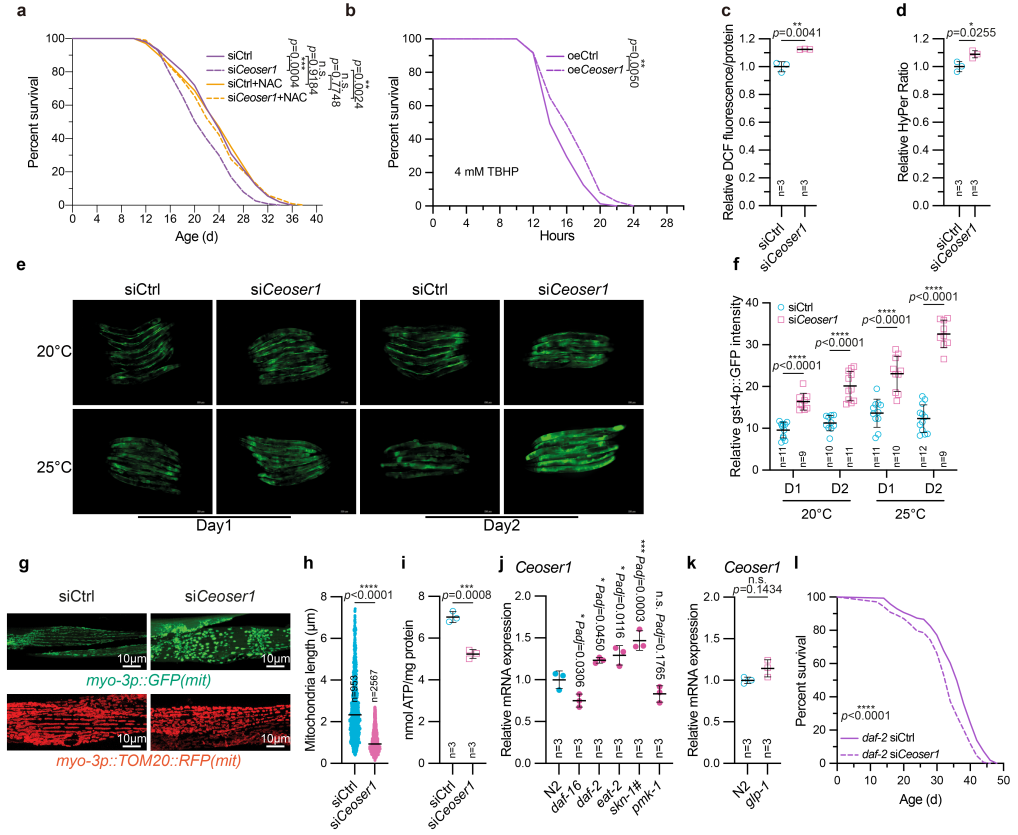
图6. 线虫中OSER1对寿命、氧化应激和线粒体的调控作用
在人类U2OS细胞中,对OSER1过表达系和RNAi敲降系中的差异表达基因分析表明,OSER1被敲降后,差异表达基因主要富集在细胞衰老、衰老相关分泌表型(SASP)、氧化应激诱导的衰老、繁殖等生物学过程,这些生物学过程之间存在密切的关联(图7)。
在家蚕中,过表达BmOSER1增强了雄蛾的交配活力,有效交配次数大幅增加,而敲除BmOSER1则降低了雌蛾的产卵量;在秀丽隐杆线虫中,Ceoser1过表达能够显著提升子代数量。这些结果共同证实了OSER1在繁殖中的重要调节作用(图8)。
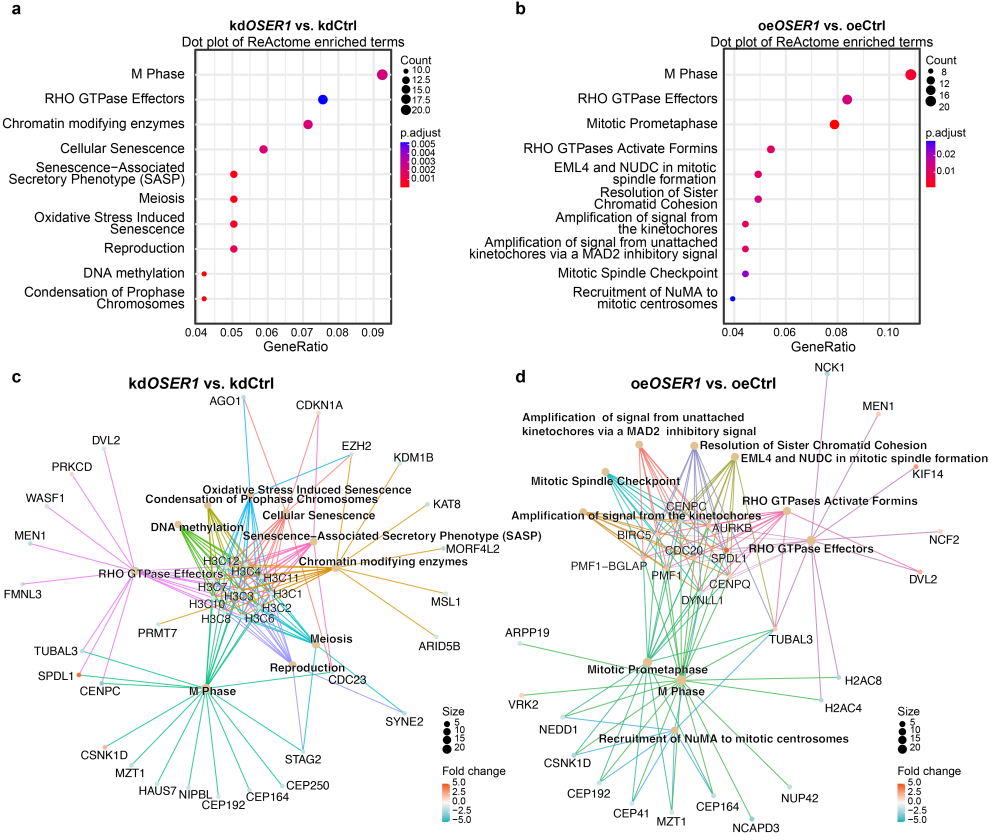
图7. 通过蛋白质组学分析鉴定人类U2OS细胞中OSER1相互作用网络
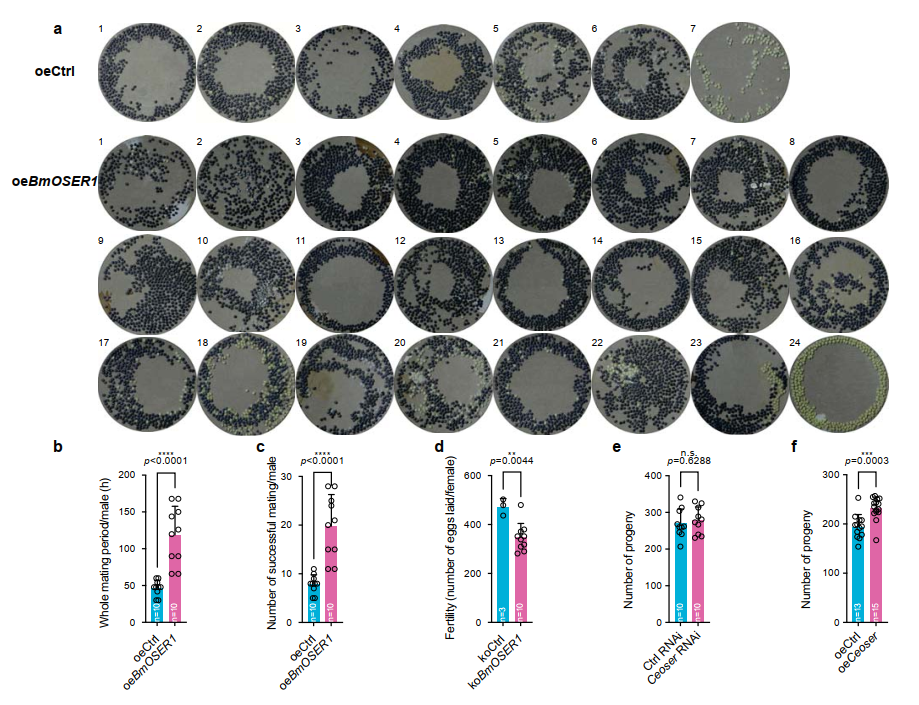
图8. BmOSER1和Ceoser1对生殖能力的影响
最后,研究了人类的OSER1基因变异。在人群队列中的分析发现,90岁以上的长寿老人与年轻对照组的比较,检测到OSER1基因中存在49个常见单核苷酸多态性(SNP),这些SNP被分为7个独立的连锁不平衡(LD)组,其中一个LD组的2个SNP的次等位基因频率与寿命显著相关(P<0.0024),另一个LD组的5个SNP与寿命显著相关(P<0.05);此外,在长寿女性中,存在次等位基因频率与绝经年龄推迟之间具有显著关联的SNP。总之,人类受试者研究结果支持OSER1也影响人类寿命的观点。
综上所述,本研究联合使用家蚕和其他经典模式生物,共同鉴定了OSER1这一物种间保守的寿命调节因子,OSER1在生物体和细胞水平上对氧化应激提供了强力的保护,从而延长生物体寿命(图9)。本研究拓展了家蚕作为研究衰老和寿命的实验生物并取得重要成果,标志着在推进家蚕模式化的进程中迈出了新的重要一步。
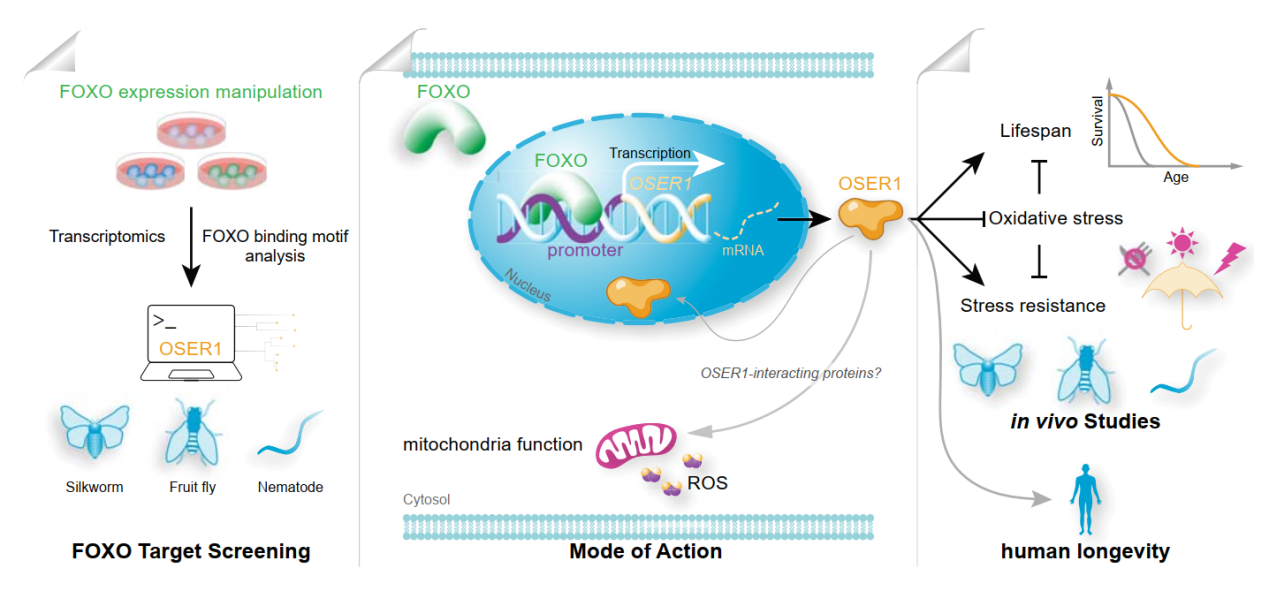
图9. FOXO靶基因OSER1参与寿命调控的作用机制图示
论文评审专家给予了热情的正面评价:“这是一项非常有意义且具有很高科学质量的工作,描述了一个相当新颖的发现。”“该研究发现了FoxO的一个新的靶基因,且生物学功能研究强力证明其具有物种间共通性,这项工作非常有趣。”“非常欣赏作者所构思的不同物种与人类间FoxO靶基因的比较,以及扎实的统计分析。”“发现新的FoxO靶标将为我们带来新的认识,并促进对FoxO调控寿命途径相关的进一步研究......发现OSER1作为FoxO的靶标将为该领域带来许多新的可能性。”
西南大学资源昆虫高效养殖与利用全国重点实验室宋江波副教授为论文第一作者,代方银教授为论文最后通讯作者;丹麦哥本哈根大学健康衰老研究中心李知泉助理研究员为论文共同第一作者,Lene Juel Rasmussen教授为论文共同通讯作者。主要合作人员还有南丹麦大学/欧登塞大学附属医院Kaare Christensen教授和Marianne Nygaard副教授,美国国家衰老研究中心Vilhelm A. Bohr教授,西南大学童晓玲教授、青年教师周磊和博士研究生陈欣。重庆大学庞珊珊教授为本研究提供了线虫材料及有关指导支持,本团队博士研究生孙涛,硕士研究生唐冬梅(已毕业)、郝凯歌(已毕业)为部分实验的完成提供了帮助,在此一并致谢。本研究由国家自然科学基金项目、重庆市自然科学基金创新群体项目等提供资助。
(撰稿:宋江波;审核:代方银)