溃疡性结肠炎(UC)是一种慢性、复发性的结肠炎症性疾病,其临床表现包括黏膜炎症、腹泻、腹痛和便血。长期炎症将促使炎症相关结直肠癌(CAC)的发生,目前临床上缺乏根治UC和CAC的药物系统。
近年来,基因编辑技术的迅猛发展为其医学应用奠定了坚实基础,特别是使用CRISPR/Cas9技术进行基因编辑,已被用于将各类外源DNA序列定向插入到基因组中,在基因功能研究领域取得了长足的进步。CRISPR/Cas9系统对结肠疾病的口服治疗,因缺乏安全、有效的递送平台而未有相关报道。因此,开发一种高效、低毒的口服药物递送系统迫在眉睫。
近日,肖波教授团队在Small发表题为“Mulberry Leaf Lipid Nanoparticles: A Naturally Targeted CRISPR/Cas9 Oral Delivery Platform for Alleviation of Colon Diseases”的研究论文。该研究利用FDA批准的Pluronic共聚物对桑叶脂质纳米囊泡(LNPs)进行表面修饰,从而提高了LNPs的胃肠道稳定性,并促进了其穿越结肠黏液屏障。桑叶脂质分子表面的天然半乳糖末端基团通过半乳糖受体介导的内吞作用,提高了巨噬细胞对LNPs的内吞效率。体外实验数据表明,Pluronic F127修饰桑叶脂质囊泡(P127M)的基因(GFP质粒)转染效率比商品化Lipofectamine 6000高2.2倍;不仅如此,载CD98质粒的P127M(P127M@pCD98)能显著降低CD98表达,下调促炎细胞因子(TNF-α和IL-6),上调抗炎细胞因子(IL-10)和促进巨噬细胞极化为M2表型。口服P127M@pCD98可通过缓解炎症、修复受损结肠上皮屏障和调节肠道微生物群来治疗UC和CAC。

【文章要点】
本研究开发了一种基于可食用桑叶脂质和Pluronic F127的CRISPR/Cas9口服靶向递送平台,所构建的脂质纳米颗粒(P127M@pCD98)可通过半乳糖受体介导的内吞作用被巨噬细胞特异性吞噬,并具有较高的溶酶体逃逸性能。进一步的体外实验表明,P127M@pCD98s通过下调CD98的表达、巨噬细胞M2极化以及减少促炎细胞因子释放等,减轻炎症反应(图1)。口服P127M@pCD98s可高效穿越结肠黏液层,跨过受损结肠上皮层,在UC/CAC组织中富集,为疾病组织位点的基因编辑提供了必要前提(图2)。
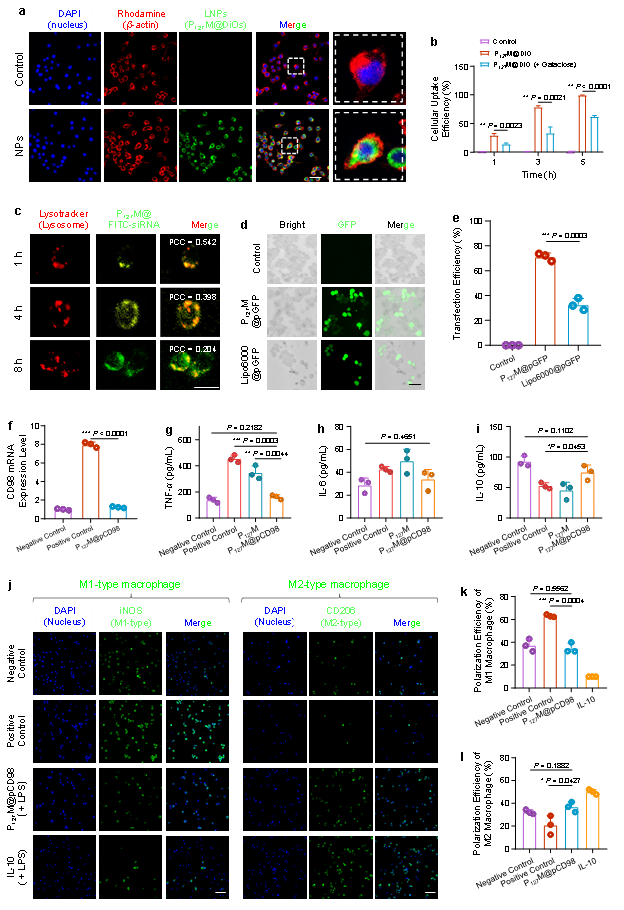
图1. 不同LNPs的体外细胞吞噬、抗炎活性及巨噬细胞极化

图2. 不同LNPs的黏液渗透和体内生物分布图
通过结肠长度、小鼠体重、髓过氧化物酶(MPO)值、脾脏指数、等参数评估了急性结肠炎的严重程度。发现P127M@pCD98通过降低促炎细胞因子(TNF-α和IL-6)水平,上调IL-10水平、恢复结肠组织形态,调节CD4+、CD8+免疫细胞数量以及肠道微生物平衡,减缓炎症;另外,该研究还揭示了CD98表面糖蛋白在结肠炎症发展中的关键信号通路(图3和图4)。不仅如此,实验结果还证实了P127M@pCD98口服后,可有效延缓CAC进展,提高有益菌的丰度,并减少有害菌的数量(图6)。
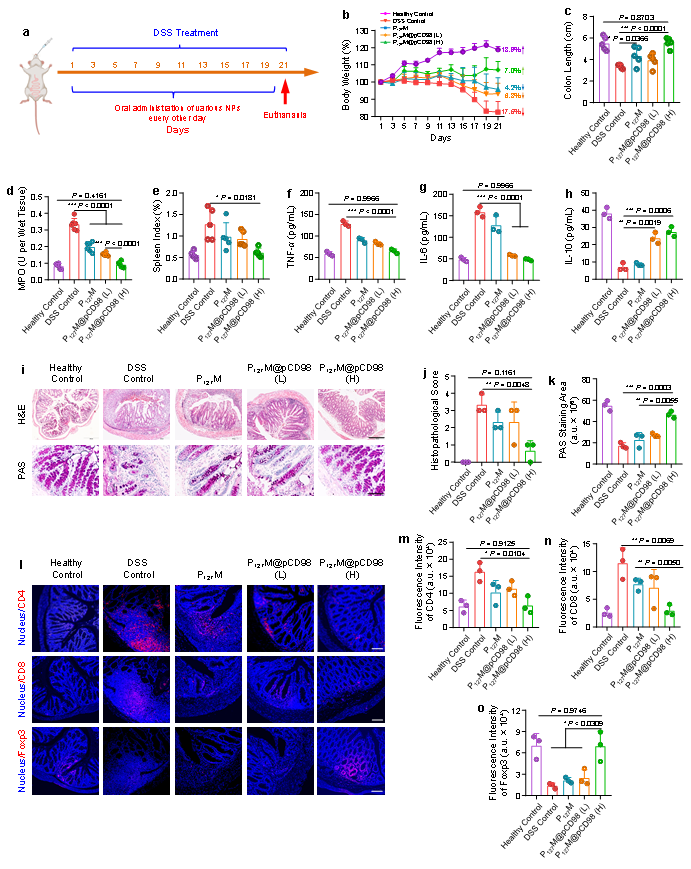
图3. 口服LNPs对DSS诱导的急性UC的治疗效果
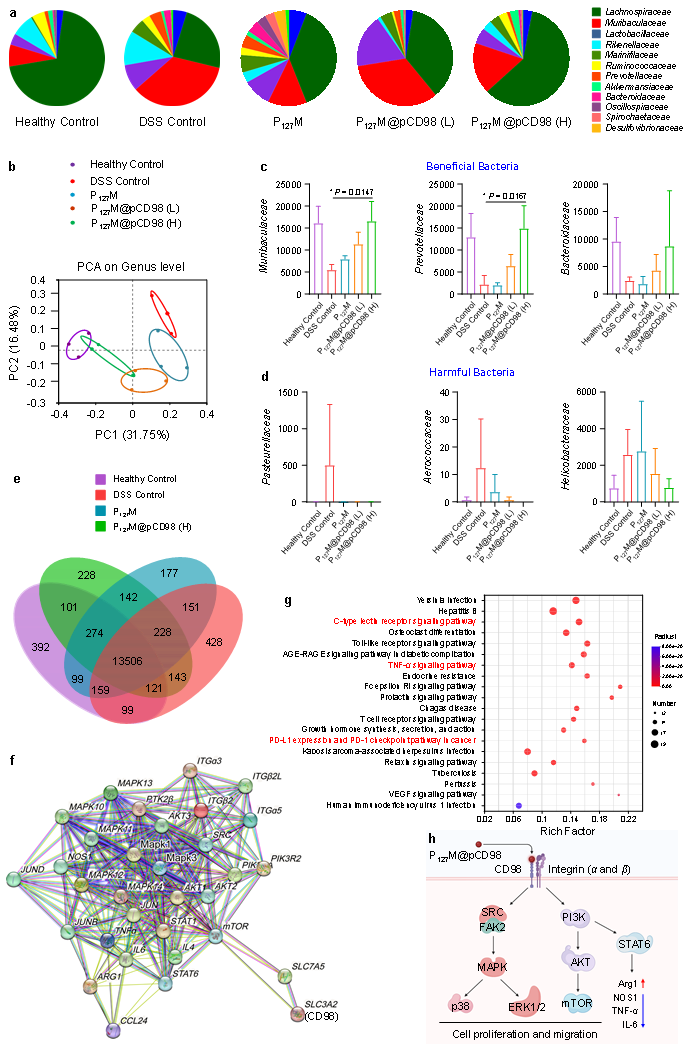
图4.口服LNPs对肠道微生物种群和结肠组织基因表达谱的影响
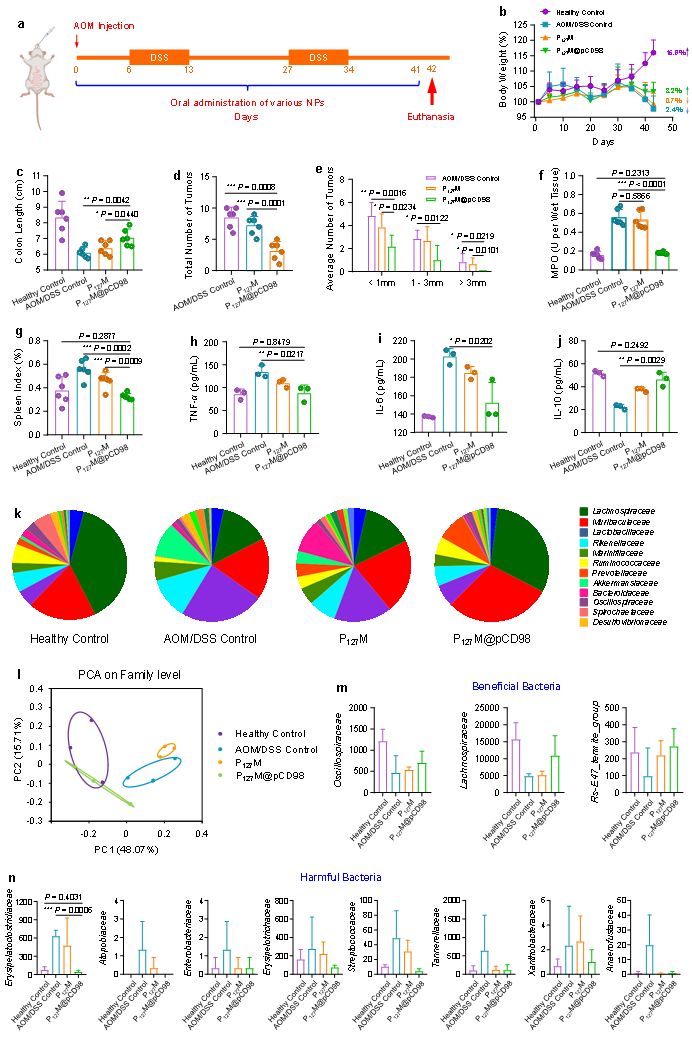
图5.口服LNPs对AOM/DSS诱导的CAC的治疗效果
【结论与展望】
在本研究中,该团队开发了一种基于可食用桑叶脂质的CRISPR/Cas9口服靶向递送平台。所构建的脂质纳米囊泡(P127M@pCD98s)具有良好的胃肠道稳定性、黏液渗透性、疾病组织(结肠炎症组织和结肠肿瘤组织)富集性和靶细胞的靶向性等性能。不仅如此,该口服脂质纳米囊泡可实现结肠组织中CD98特异性敲除,通过缓解结肠炎症、促进受损结肠上皮修复和调控肠道菌群平衡等途径有效治疗结肠疾病(图6)。

图6. P127M@pCD98s的制备及其抗结肠疾病的作用机制
西南大学资源昆虫全国重点实验室为论文第一署名单位,硕士生马灵莉为论文第一作者,西南大学肖波教授、代方银教授和重庆大学蔡开勇教授为论文的共同通讯作者。本研究受国家自然科学基金、重庆市杰出青年基金项目和重庆市留学归国人员创业创新支持计划等资助。
(供稿人:肖波,审稿人:代方银)