1. 构建柞蚕丝素纳米粒子,提高药物对肠道炎症的口服精准治疗效果
溃疡性结肠炎(UC)是一种反复发作的慢性结肠炎症,常伴随有结肠上皮屏障受损、粘膜炎症、ROS过度产生和肠道微生物失调等。团队前期报道了基于桑蚕丝素的口服纳米药物系统经靶向分子修饰后,可对UC实现靶向治疗(Biomaterials 2019, 212:39;已被引129次),然而靶向分子的修饰过程往往涉及复杂化学反应和有毒催化剂。
我国拥有丰富的蚕丝蛋白资源,通过解析不同蚕丝蛋白的组成及各组份的一级结构、二级结构等,发现柞蚕丝素是一种潜在的能用于炎症治疗的多功能(靶向等)生物质。结肠炎症组织中的结肠上皮细胞和巨噬细胞的表面高度表达整合素蛋白,能与精氨酸-甘氨酸-天冬氨酸(RGD)三肽特异性结合,而柞蚕丝素(ApSF)中恰好含有丰富的RGD三肽结构。基于此,研究团队将桑葚来源白藜芦醇(Res)装载于柞蚕丝素纳米粒子中,获得载Res的纳米药物(Res-ApNPs)。该Res-ApNPs具有结肠上皮细胞/巨噬细胞双重靶向、多重刺激响应和溶酶体逃逸等性能。值得指出的是,Res-ApNPs还能促进炎症缓解、上皮修复、自由基清除和肠道菌群调控等,表明该结构简单、易于制备的基于柞蚕丝素的纳米药物在炎症疾病的治疗方面具有良好的应用前景。该项研究成果于2022年2月发表在生物材料领域重要期刊Biomaterials(IF = 15.4),博士生马雅为论文第一作者,段炼副教授为论文的共同第一作者。同时获得授权国家发明专利1项(专利号:2019 1 0738517 3)。
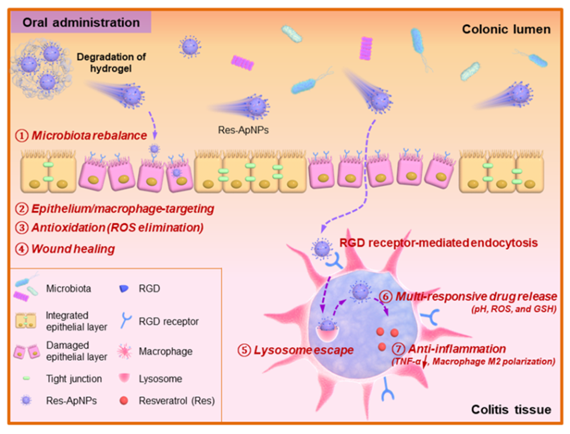
论文链接:https://www.sciencedirect.com/science/article/abs/pii/S0142961222000497
2. 抗菌肽表面功能化,提高丝素纳米药物改善肠道炎症微环境性能
抗菌肽是一类具有抗微生物活性的短肽,其作用范围包括细菌、真菌、病毒和寄生虫。此外,某些抗菌肽还具有促进血管再生、黏膜修复和免疫调控等功能。研究团队利用金环蛇抗菌肽(CBFs)对丝素纳米药物进行表面功能化,获得了CBF-EGCG-NPs。细胞实验发现该纳米药物能够减少活性氧的产生、保护正常细胞免受ROS损伤、抑制促炎细胞因子的表达(TNF-α和IL-12)、提高抗炎细胞因子IL-10的表达量和吸附细菌脂多糖(LPS)。进一步的动物实验结果表明:CBF-EGCG-NPs不仅可以有效缓解和治疗UC,还可以提高肠道有益菌(如Firmicutes和Lactobacillaceae)的含量。该项研究成果于2022年5月发表在药剂学领域重要期刊Journal of Controlled Release(IF = 11.4),硕士生生刘胜胜为论文第一作者。
论文链接:https://www.sciencedirect.com/science/article/abs/pii/S0168365922002887
3. 柞蚕丝素表面修饰纳米马达实现肿瘤深度渗透,提高对恶性肿瘤的高效靶向协同治疗效果
免疫治疗是一种通过激活免疫系统杀死肿瘤细胞的强有力的临床治疗癌症的方法。然而,由于该治疗手段在免疫原性低、癌细胞转移率高和复发率高等方面存在诸多限制,目前仍有大量的乳腺癌患者们无法从该种治疗策略中获益。另一方面,乳腺肿瘤微环境(TME)的高间质压和致密的纤维化基质也阻碍了治疗药物和免疫细胞的渗透。研究团队构建了具有多重刺激响应性的柞蚕丝素蛋白(ApSF)表面功能化介孔硅粒子(MSN),可将化疗药物盐酸阿霉素(DOX)和光敏剂吲哚菁绿(ICG)衍生物(IDs)分别递送至肿瘤细胞的特定细胞器。在近红外光照射下,纳米马达可以渗透至肿瘤组织内部,自产氧,并实现多模态成像引导的线粒体光疗。实验证明该新型治疗方法可在转移性乳腺肿瘤的抑制和系统性抗肿瘤免疫反应的增强上实现协同作用功效。本研究首次报道了ApSF功能化MSN粒子的构建,通过直接杀死肿瘤细胞和增强系统性抗肿瘤免疫,实现了转移性乳腺癌的靶向协同治疗。该项研究成果于2022年4月发表在生物材料领域重要期刊Advanced Healthcare Materials(IF = 11.0),硕士生张雪卿为论文第一作者,英国牛津大学孙鉴锋博士为论文的共同第一作者。
论文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adhm.202200255
4. 丝素蛋白/硫酸软骨素表面双功能化介孔粒子,实现结肠癌的口服靶向超声-化学动力-免疫协同治疗
免疫治疗开创了恶性肿瘤治疗的新格局,但是结肠癌免疫抑制微环境严重制约了其治疗效果。口服药物递送是最常见的临床给药途径,然而药物经口服后需克服多重递送屏障。如何实现口服药物高效递送以及克服结肠癌免疫抑制微环境已成为重大挑战。研究团队构建了丝素蛋白和硫酸软骨素共修饰的载药介孔二氧化锰,并利用壳聚糖和海藻酸钠水凝胶包裹纳米载药马达(CS-ID@NMs)构建口服药物递送系统。经口服后,水凝胶于结肠部位崩解并释放纳米马达。该纳米马达在超声和结肠癌微环境ROS的双重驱动下,成功穿越黏液并渗透到肿瘤组织深部。不仅如此,超声还可帮助纳米马达实现溶酶体逃逸,并在肿瘤细胞胞内微环境刺激下特异性释放线粒体靶向声敏剂。所释放的二价锰通过芬顿反应产生大量羟基自由基,催化过氧化氢产生氧气克服肿瘤乏氧,提高超声动力学效率,促进肿瘤脂质过氧化,加速肿瘤细胞铁死亡,促使释放肿瘤抗原,联合Anti-PD-L1,逆转免疫抑制微环境,从而有效抑制了原位结肠癌和转移结肠癌。该项研究成果于2022年8月发表在纳米微米领域重要期刊Small(IF = 15.1),硕士生曹银贵为论文第一作者。
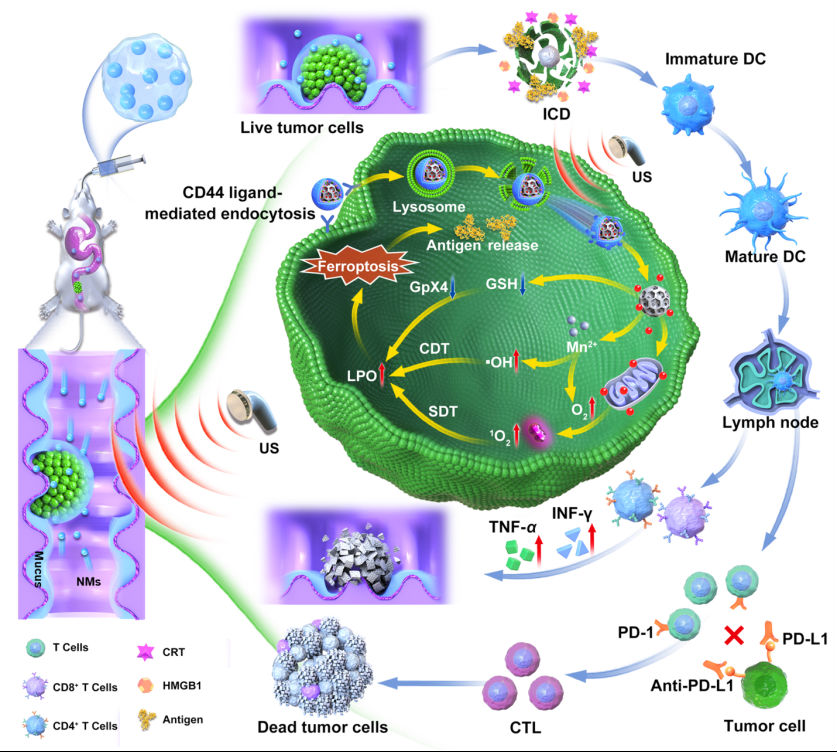
论文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/smll.202203466
5. 光活性家蚕平板丝敷料,促进MRSA感染创面修复
烧伤和创伤等伤口常常容易遭受细菌感染,从而引起败血症、急性肾衰竭和其他感染相关的并发症。耐药性细菌的出现进一步加剧了它们的威胁,耐甲氧西林金黄色葡萄球菌(MRSA)是最为常见的耐药性病原菌。针对传统光抗菌材料在黑暗条件下丧失抗菌功能的问题,研究团队以绿色、天然的家蚕平板丝为基底材料,利用蒽醌类有机光敏剂与石墨相氮化碳之间的协同效应,开发出一款高效、全天候杀灭细菌的平板丝抗菌敷料。该敷料不仅具有良好生物相容性、高效抗菌活性,同时解决了传统无机光敏材料如二氧化钛等与有机高分子载体之间结合力弱的问题。更为重要的是,该敷料类似于有“可充放电太阳能电池”,利用有机光敏剂的特定结构,在光照激发条件下发生分子结构重排,将抗菌活性存储起来,并在黑暗条件下缓慢释放活性氧,破坏细菌膜结构,达到持续抑制细菌的目的。该研究以绿色、环保的家蚕平板丝为基底载体,实行光敏剂的功能化后,在光照下产生大量活性氧,能有效杀灭细菌,并具有促进胶原蛋白合成、血管再生和创伤修复的功能。不仅如此,该敷料具有优异的生物安全性,在感染创伤修复方面展现了良好的应用前景。该项研究成果于2022年8月发表在生物材料领域重要期刊Advanced Healthcare Materials(IF = 11.0),易世雄副教授为论文第一作者,硕士生周鹰为论文第二作者。

论文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adhm.202201397
此外,研究团队在农业生物质资源的生物医学利用方面同样取得了进展。茶树花被认为是茶叶生产中的“废弃物”。为实现茶树废弃物质资源化利用,研究团队从茶树花中分离、纯化获得大量外泌体样纳米囊泡(TFENs)。经静脉注射或口服后,TFENs抑制原位乳腺癌和转移瘤的生长及其恶性转移。该研究为植物类外泌体治疗平台的规模化生产和农业“废弃物”的高值利用带来了新思路(Acta Pharmaceutica Sinica B 2022;12:907;IF = 14.9; 已入选ESI高被引论文)。研究团队还从重庆本地一种特色茶叶中提取了纳米囊泡,研究发现该纳米囊泡刺激肿瘤细胞内活性氧的产生,诱导细胞发生凋亡,阻滞细胞周期进行,进而抑制肿瘤细胞增殖。该项工作为植物衍生纳米囊泡经口途径抑制肠道外肿瘤提供了新的应用方向(Journal of Nanobiotechnology 2023;21:6;IF = 9.4)。在前期应用研究基础上,团队研究生以《茶里长安—天然靶向鲜茶纳米功能饮》为项目名称,在第八届“萌番姬杯”国际大学生农业创新创业大赛中荣获“潜力创业团队奖”,表明该茶叶生物质研发项目具有重大转化前景。
肖波教授为上述论文的最后通讯作者。基于在蚕丝等农业生物质资源开发、加工与生物医学利用方面的研究积累,肖波教授先后入选国家级青年人才、“全球2%顶尖科学家”(2021/2022)、“全球前10万顶尖科学家” (2022)和重庆市杰出青年科学基金获得者等。西南大学家蚕国重室代方银教授、葡萄牙米尼奥大学Subhas Kundu教授和四川大学华西医院应炳武教授等为上述研究的开展提供了大力帮助。
上述研究得到了国家有关青年人才项目、国家自然科学基金(51503172, 81571807和82072060)、西南大学先导计划项目和重庆市自然科学基金(杰青项目和面上项目)等资助。
供稿:肖波教授团队 审核:代方银